CRISPR, la famosa técnica de edición genómica, no sólo sirve para curar enfermedades, también para recrearlas en modelos celulares con los que estudiar los eventos moleculares que las originan. Estos modelos son cruciales, además, para el estudio de nuevas vías diagnósticas y terapéuticas.
En el trabajo publicado en la revista Stem Cell Reports, los autores presentan un avance técnico significativo para recrear el sarcoma de Ewing en células madre humanas adultas y embrionarias.
“La idea es tener un sistema que permita generar un modelo lo más fidedigno posible a lo que está pasando en un tumor”, señala Sandra Rodríguez Perales, de la Unidad de Citogenética Molecular e Ingeniería Genómica y líder de la investigación.
De este modo, con un modelo que reproduzca los orígenes de la enfermedad, será posible analizar los mecanismos y bases moleculares que subyacen a cada patología. En el caso del sarcoma de Ewing, el desencadenante es una translocación entre los cromosomas 11 y 22, que da lugar a la fusión de dos genes, generando un nuevo oncogen.
Los autores ya habían empleado CRISPR para inducir esta alteración y generar un modelo de esta enfermedad, pero se habían topado con una baja eficacia y otras dificultades metodológicas al aplicar la técnica en células madre humanas.
“Cuando trabajábamos con líneas celulares, todo iba como la seda, pero cuando lo hacíamos concélulas madre, encontrábamos muchos problemas”, explica Raúl Torres Ruiz co-autor del estudio.
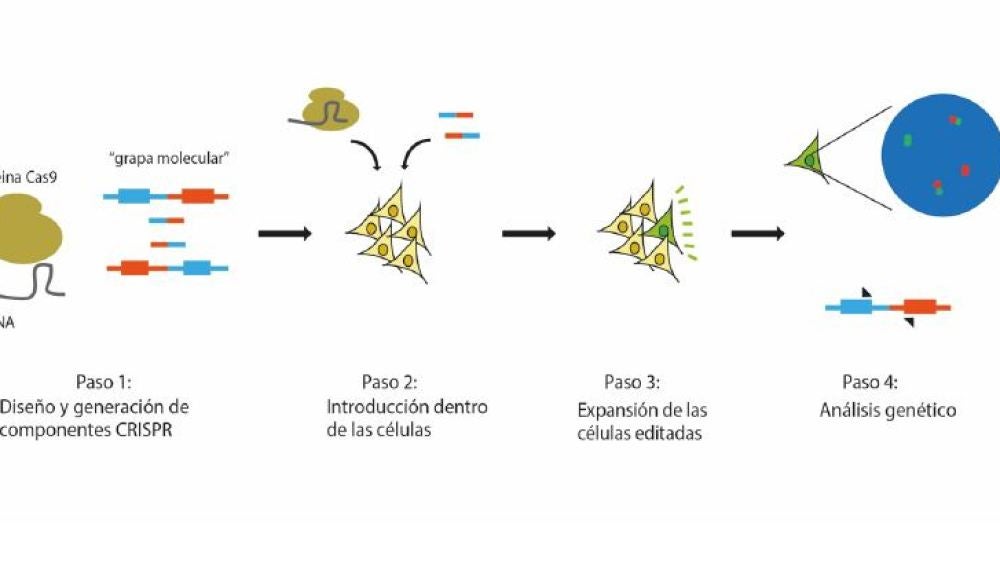
Con el fin de mejorar sus resultados y de afinar la técnica, compararon tres estrategias para generar esta translocación de la forma más eficaz posible utilizando CRISPR. Tras varios experimentos, observaron que combinando el uso de un complejo ribonucleoproteico sgRNA-Cas9 generado en el laboratorio (en lugar de un plásmido de expresión) y de una “grapa” de ADN –una secuencia corta que une los extremos de los dos cromosomas que rompe el sistema CRISPR y que facilita por tanto la producción de la translocación– la tasa de éxito se multiplicaba hasta por siete. Esto indica, según losautores, que estamos ante “una herramienta sólida para [inducir] translocacionesdirigidas”.
Todas las mejoras aplicadas durante el estudio han permitido a los autores generar dicho modelo en células madre pluripotentes inducidas (iPSC), que poseen un granpotencial desde el punto de vista científico, dado que constituyen un modelo celular idóneo para el estudio del desarrollo de distintas patologías, entre ellas los estadios iniciales de procesos oncogénicos. Todo ello permitirá el estudio de las bases mecanísiticas de patologías como el sarcoma de Ewing.
Es decir, no sólo puede ser útil para este sarcoma sino que es “una aproximación válida también para otras patologías”, subraya Rodríguez Perales. “Esta estrategia –concluyenlos autores– facilitará la creación de modelos de cáncer con células madre humanas y la edición genómica de precisión para la búsqueda de nuevos fármacos o terapias celulares, acelerando así el paso del laboratorio a la clínica”.Esta investigación ha sido financiada por el Plan Estatal de Investigación Científica y Técnica y de Innovación, el Instituto de Salud Carlos III y FEDER (PI14/01884 y PI12/00425) y el Lady TATA Memorial Trust.
BASADO EN LA TÉCNICA DE CRISPR
BASADO EN LA TÉCNICA DE CRISPR
Un equipo del CNIO crea un sistema para recrear el sarcoma de Ewing en modelos celulares
Un equipo del Centro Nacional de Investigaciones Oncológicas (CNIO) ha perfeccionado un sistema capaz de generar un modelo celular de sarcoma de Ewing. La técnica, basada en CRISPR y descrita en las páginas de Stem Cell Reports, permitirá generar modelos celulares para analizar los mecanismos que subyacen a la aparición y desarrollo de ésta y otras enfermedades, así como la búsquedade nuevos tratamientos.
Los mas vistos
-
1
Compromiso Atresmedia
Investigadores españoles descubren una asociación entre la reducción de oxígeno en el cerebro y el Alzheimer
-
2
Compromiso Atresmedia
Los diez avances científicos más destacados de 2023
-
3
Compromiso Atresmedia
El Congreso apoyará la tramitación de la proposición de ley sobre enfermos de ELA
